+86 13683842418
+86 13683842418
河南省洛阳市洛阳国家大学科技园
作者:刘康生 项兰兰 茅晓东 陈亚军
单位:南京医科大学附属妇产医院实验诊断科
【摘要】
实时荧光定量 PCR 技术比传统的 PCR 技术更加精准,定量准确、重复性好,速度快,解决了传统的 PCR 技术在准确定量方面的缺陷,是迄今为止重现性较好的定量方法.目前,该项技术被广泛应用于基因表达研究,药物疗效考核、病原体检测,肿瘤检测等诸多领域。同时,在提取核酸前不仅需要除去或减少对实时荧光定量 PCR 扩增的干扰和污染物质,同时还要保证核酸高纯度,高浓度的提取。实时荧光定量 PCR技术为乳腺癌等妇科肿瘤的早期诊断、 预后判断、 化疗方案的选择等提供了重要帮助。本文将就乳腺癌等妇科肿瘤相关PCR诊断技术的新进展作一综述.
【关健词】
实时荧光定量 PCR ,妇科肿瘤,质控要素, 污染控制
近年来各种妇科肿瘤的发病率呈逐年上升的趋势。比如,每年我国乳腺癌新发病例和死亡病例分别占全世界的12.2%和9.6%[1-2]。 一般来说, 乳腺癌等妇科肿瘤早期无任何临床症状,早期发现及治疗对降低各种妇科肿瘤病死率改善预后起到很大作用。目前,许多发达国家对于妇科肿瘤的诊断与治疗多在早期,其中肿瘤标志物在肿瘤的诊断、分型、分期、预后诊断等过程中发挥着重要的作用,所以肿瘤的实验室诊断检测意义重大[3-4]. 实时荧光定量 RCR技术是指在RCR反应体系中加入荧光基团, 通过荧光信号积累对整个RCR进程实时监测。荧光染料能特异性渗入DNA双链, 发出荧光信号, 从而保证荧光信号与RCR产物同步增加。其定量的原理在于靶基因初始拷贝数越多, 所产生的循环阈值越小. 近年来,国内相应比较成熟研发机构配套的实时荧光定量 PCR试剂应运而生(诸如:达安基因等)。 本文将就近年来乳腺癌等妇科肿瘤相关PCR诊断技术的新进展作一综述如下:
一、 实时定量PCR 技术基本原理
实时荧光定量 PCR 技术是传统PCR与已有分子生物学技术的结合形成的一种PCR衍生技术,有较强的特异性和应用的广范性。即在反应体系中加入荧光基团, 通过荧光信号的实时积累进而监测整个 PCR进程, 最后通过已知标准曲线对未知模板进行定量分析的方法。 一般常用的定量 PCR,包括荧光染料法和水解探针法。染料法(SYBR Green Ⅰ ) [5]:染料法中以 SYBR Green I法的应用最为广泛。一种只与双链 DNA 小沟结合的具有绿色激发波长的染料,结合所有 DNA 双链小沟。 反应体系中, 过量的 SYBR 染料,结合时,SYBR 特异掺入 DNA 双链小沟, 发射荧光信号,多余的 SYBR 不会发射任何荧光信号,保证收集的荧光信号与 PCR 产物的增加量保持一致。
TaqMan 探针法:TaqMan 探针法是区别于分子信标和FRET探针法较常用的实时荧光定量 PCR 技术。基本原理如下图,是利用 Taq 酶的 5′核酸外切酶活性, 切割与靶序列结合的寡核苷酸探针。探针由 5′端标记报告基团,3′端标记淬灭基团构成。 反应前,荧光报告基团和荧光淬灭基团形成共振体系,3′淬灭基团抑制 5′荧光基团的荧光发射。反应时,当引物延伸至探针结合位置时,Taq酶可以将其切割成小片段,破坏了探针的完整性,稳定的能量传递结构瓦解,发出荧光信号,PCR 反应一轮,荧光信号被收集一次,进而实现实时监测整个反应过程[6-8]。
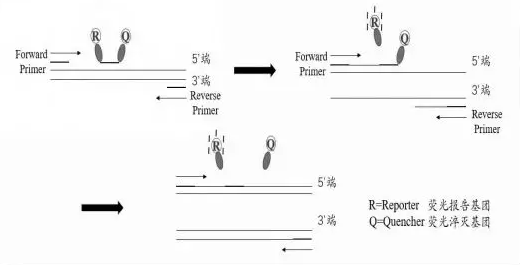
TaqMan 探针的基本原理[7-8]
二,实时定量PCR操作中质控关键要素
样本的接收:对于蛋白质分子分析或基因表达的分析实验,组织标本需进行真空包装,并在低温状态下转运到实验室[10]。因此,组织标本均需采用冷链物流进行保存和运输。送检的样本不论是新鲜组织或活检穿刺标本,均统一送至病理技术室进行标准化的取样前处理。样本先经评估并进行组织切片,经HE染色后由病理医生进行病理诊断、评估肿瘤细胞总数及比例、标识肿瘤细胞丰富的区域用以富集和收集肿瘤细胞 [11]。
提取DNA浓度的检测:一般可从5-7片、厚度为 5-6微米的蜡块切片中提取DNA。如果提取所得DNA浓度达不到要求范围则可能出现假阴性的检测结果,因此, PCR扩增前必须进行提取DNA浓度检测。而使用荧光定量法能够准确检测2-20 μl样本 中0.2-100 ng的DNA。采用荧光染料法进行各种复杂溶液中DNA浓度检测时,荧光染料可分别与双链DNA、单链 DNA、RNA或蛋白质特异结合,并在不同的特定波长光源的激发下发出荧光。由于对目的分子具有极高的特异性, 在特定波长激发下,该系统不会检测到样本中可能存在的其他杂质分子,如游离核苷酸等,荧光强度与样品中的靶子浓度相对应,实现选择性定量[12]。
疾病发展过程中标本采集的注意事项:适当时机采集标本,严重急生呼吸道综合征(SARS)冠状病毒感染,其在感染发病后3-4天,即可在较高浓度出现于上或下呼吸道标本中,在第10-13天,在尿液中出现的浓度最高,而在血液,则不但存在时间段,而且浓度底。再如:HBV,HCV,HIV感染时,机体感染后,在特异抗原和抗体出现以前,血循环中即可有较高浓度病原体存在,而抗体出现后,病原体的出现是不一样的[13]。有的可能会低于RT-PCR方法的测定下限,换句话说,在特异性抗体存在的情况下,病毒核酸检测却表达为阴性的现像(在测定中需注意的情况)。又比如:对于生殖道分泌物标本采集上,正确的方法是:应该将拭子深入至尿道口2-3cm处用力转1-2圈。送检时间:标本采集后尽快送专业分子实验室检测,用于DNA测定的EDTA抗凝血(由于肝素是一种非特异的核糖核酸酶抑制剂,不能通过核酸提 取过程将其去除,所以对后续 PCR 扩增检测有严重干扰)。用于RNA测定的加了GITC的血清或血浆标本可在室温下进行邮寄或运送。如血液标本来后,分离血清,分出2管来,1管用于测定,另1管长期保存备查[14]。
检测试剂和方法的标准化(污染控制):在使用商品核酸提取试剂提取临床标本中的核酸模版前,应对其有效性进行充分评价。标本中存在大量抑制物是影响核酸制备质量的关健(包括:血红蛋白及其前体或降解产物,另外就是核酸提取过程中的残留有机溶剂,如氯防等),它们都对TaqDNA聚合酶具有抑制作用,从面影向靶核算的扩增测定。另外,反转录PCR测试失败的原因往往是标本在运送前未经过充分稳定化处理及核酸提取试剂盒里RNA酶污染,对于后者,建议采用高质量的核酸提取试剂盒。为使临床标本中可能存在的核酸酶失活,可加入Chaotropie物质,最常用的是4mol/L GITC,并同时与还原剂如β--巯基乙醇一起使用。使用终浓度为5mol/L的GITC,可使RNase不可逆失活,使用GITC作为稳定剂保存靶核酸为RNA标本,标本可在室温稳定7小时[15]。
实时定量PCR因其极高的检测灵敏度,很容易出现假阳性结果(因以前扩增产物或标本间交叉污染)。因此试剂产家在研发相应临床分子诊断试剂时,必须仔细考虑上述所述因素。如何有效避免假阳性或假阴性结果的角度出发,在试剂盒中以dUTP替代4种dNTP中的DTTP,再加上尿苷糖基酶(UNG),使扩增产物DNA中出现天然的DNA中所没有的U,在新的检测扩增中,如有以前扩增产物的污染,则其可在UNG的作用下被降解[16].国内很多相应比较成熟研发机构配套的实时荧光定量 PCR试剂应运而生(较早研制的诸如:达安基因等,其特点是:高精度、高得率——根据试剂优化提纯方案,配合精准的温育时间,实现更高的提取效率,提取的DNA/RNA可直接用于PCR/RT-PCR)。
三.实时定量PCR在妇产科肿瘤疾病中的应用
3.1实时定量 PCR技术在乳腺癌检测中的应用
早期乳腺癌复发转移的预测与防治是乳腺癌研究的前沿课题,尤其是外周血循环肿瘤细胞及腋窝淋巴结微转移的检测逐渐成为乳腺癌研究的重点[17]。其中常见的标志性蛋白有乳腺上皮小黏蛋白(SBEM)、细胞角蛋白19(CK19)及乳腺株细胞(hMAM)[18]等。陆慧琦等[19] 运用实时荧光定RT-RCR测定乳腺癌组织中雌激素受体,孕激素受体和人表皮生长因子受体2基因的表达.用免疫组化染色法作为对照, 结果发现实时荧光定量RT-RCR检测方法可用于雌激素受体, 人表皮生长因子受体2和孕激素受体 mRNA 表达的临床检测和研究 。有研究者应用实时荧光定量RCR检测乳腺癌患者外周血中表皮生长因子受体及细胞角蛋白20并分析其临床病理联系 ,发现此两项指标联合检测可作为乳腺癌诊断, 治疗及预后的参考指标[20]. 2015年王卉等[21]应用实时荧光定量RCR探讨微小RNA-21在乳腺癌细胞和患者血清中的表达及其与乳腺癌侵袭转移的关系, 使得血清中微小 RNA-21的表达成为乳腺癌辅助诊断及预后判断的新的分子标志.
李文仿等[22]采用PCR技术检测hMAM在15例正常乳腺组织及15例乳腺增生组织中的表达情况,结果显示hMAM-mRNA在乳腺癌组织中高表达,这提示其有可能成为乳腺癌微转移检测的分子标志物,Tjensvoll K等[23]也提出高表达hMAM的患者肿瘤更易复发、转移,这也表明乳腺癌组织中乳腺珠蛋白表达成为乳腺癌的预后判断的重要依据。2013年研究者[24]采用Real-Time PCR技术检测乳腺癌组织与正常乳腺组织中PDX-1和β-catenin mRNA的表达与分化程度、淋巴结转移及TNM分期之间的关系,结果显示PDX-1和β-catenin蛋白和mRNA的表达与乳腺癌的分化程度、淋巴结转移显著性相关,提示 PDX-1 和 β-catenin 可能参与肿瘤细胞的分化及转移过程,并提示PDX-1和β-catenin的检测对判断乳腺癌的预后有重要价值。在蛋白表达与乳腺癌微转移、预后等的检测中除了Real-Time PCR技术以外,反转录PCR[25],免疫组化等方法也被大量采用。
3.2 实时定量PCR技术在卵巢癌检测中的应用
卵巢癌的发病率居妇科恶性肿瘤的第三位,病死率居首位[26]。该病起病隐匿,缺乏有效准确的早期诊断方法,70%以上的卵巢癌患者发现时已为晚期 [27],失去了最好的治疗时机。因此积极探人附睾蛋白4(HE4)是近年来发现的一个新基因,大量的研究表明HE4是一个优秀的鉴别卵巢良恶性病变的生物标志物[28],Schummer等[29-30]采用Real-Time PCR技术进行检测,发现晚期卵巢癌经过手术和治疗,在复发前4-5个月就有HE4升高现象,提示HE4可用于检测卵巢癌复发,近期周萍采用RT-PCR法检测卵巢上皮性癌中的CD146的表达情况,并探讨其表达与临床病理分期的相关性。结果表明,CD146 的高表达与卵巢上皮性癌的发生、发展有关,可以作为卵巢癌预后及复发的特异性标记物,有可能是其诊断、术后随诊及靶向治疗的潜力分子[31].
3.3实时荧光定量 PCR在子宫内膜癌与癌旁组织检测中的应用
子宫内膜癌是女性生殖系统常见的三大恶性肿瘤之一,近年在世界范围内其发病率和病死率均有上升趋势 某些欧美国家,子宫内膜癌已经成为妇科恶性肿瘤的首位 .周赞华的研究首次在子宫内膜癌和癌旁组织中运用 qRT- PCR 技术检测 microRNA- 93 的表达情况,结果显示子宫内膜癌组织中 miNAR- 93表达水平明显高于癌旁组织,表明 mi-croRNA- 93 在子宫内膜癌中表达上调, microR-NA- 93 在子宫内膜癌发生发展中表现为癌基因的作用。microRNA- 93 作为一种新发现的非蛋白编码基因,其在肿瘤的发生发展、 临床诊疗及预后判断等方面的研究价值已得到广泛的认可,有可能成为子宫内膜癌的重要分子靶标,为探索子宫内膜癌特异性诊断和治疗的新方法提供理论依据[32]。
3.4实时荧光定量PCR在宫颈癌组织检测中的应用
近几年,程跃建在妇产科选取经组织活检确诊的宫颈癌、宫颈糜烂患者及宫颈组织正常者共125例,采集其宫颈组织并进行HPV DNA实时荧光定量PCR检测,观察HPV DNA的检出率和病毒水平,60例宫颈癌组织中检出HPV 16、18型DNA检出54例,检出率为90.00%,DNA模板平均拷贝数为4.83×105 copy/mL,其中HPV 16、18型DNA均阳性者8例,仅检出HPV 18型DNA阳性者6例,仅检出HPV 16型DNA阳性者32例。结果发现HPV DNA水平与宫颈癌的发生有相关性,且HPV DNA拷贝数随病情加重而增加,测定HPV DNA水平对宫颈癌的筛查有重要的临床意义[33]。
四.小结
实时荧光定量PCR 技术自推出以来得到了飞速发展和广泛应用,显示了其强大的生命力和发展潜力。与传统的PCR技术相比其使用了荧光探针标记特定核酸从而提高了准确性;荧光标记核酸化学技术和寡核苷酸探针杂交技术的发展以及实时荧光 RT-PCR 技术的应用,使定量 RT-PCR 技术用于更广阔的研究领域,有助于人类和动物肿瘤相关疾病的早期诊断与基因分期、分型,以及对人类妇科肿瘤转移的早期发现及预后判断。同时,相信随着检测试剂标准化不断发展,不同厂家PCR检测试剂盒的创新及自动化,生物标本的前处理防污染控制会更简便、全 面、高效。
五、参考文献
[1]. Steven S, Coughlin. The Impact of the Natural, Social, Built, and Policy Environments on Breast Cancer. J Environ Health Sci. 2015;1(3). doi: 10.15436/2378-6841.15.020. Epub 2015 Aug 3。
[2] 林镪 ,刘毅,梁峰等.乳腺癌前哨淋巴结分子病理检测技术的验证 RT-LAMP 与Gene Search技术的对比研究[J]. 军事医学 2015 5373-5376.
[3] 郭晓慧, 于小玲. 实时荧光定量PCR法检测卵巢良、恶性肿瘤中Id1 mRNA的表达[J]. 现代肿瘤医学, 2011,19(11): 2299-2301.
[4] 张昆丽, 谢芝勋, 滕丽琼, 等. 鸡白细胞介素1β、白细胞介素18、肿瘤坏死因子α基因荧光定量PCR检测方法的建立[J]. 中国畜牧兽医, 2013,40(9): 90-95
[5]刘歆,徐根明,郭江峰 等. 基于SYBR GreenⅠ的双链DNA定量方法[J].中国生物工程杂志,2008,28(1):55-60.
[6].陈光,吴盛海,余道军 等。基于DPO的四重荧光PCR检测常见分枝杆菌方法的建立与应用 [J],中华检验医学杂志,2012,35(8):722-725.
[7].李红霞 . 两种Taqman探针的制备及荧光检测性能比较[J]。化学研究与应用 2011;8:1057-1061.
[8].牛 犇 .荧光定量PCR在预测微生物学中应用。食品工业科技。2018.10.1-18
[9]. Cree IA, Zandra D, Ligtenberg M, et al. Guidance for laboratories performing molecular pathology for cancer patients[J]. J Clin Pathol, 2014,67:923-931.
[10] Cree IA, Zandra D, Ligtenberg M, et al. Guidance for laboratories performing molecular pathology for cancer patients[J]. J Clin Pathol, 2014,67:923-93
[11]ApostolidiED, PsallaD, ChassalevrisT, etal.Developmentof real-time PCR-based methods for the detection of enzootic nasal tumor virus 2 in goats. Arch Virol. 2019 ;164(3):707-716.
[12] Douillard J, Ostoros G, Cobo M, et al. First-line gefitinib in Caucasian EGFR mutation-positive NSCLC patients: a phase-IV, open-label, single-arm study[J]. Br J Cancer, 2014,110(1):55-62.
[13]李艳梅,江忠勇,李志强。实时荧光定量PCR HBV-DNA检测系统性能验证方法的探讨。西南国防医药 2018.28(12):1177-1179.
[14]陈艳.实时荧光PCR检验用于乙肝病毒DNA检测的临床价值[J] 临床研究 2018;26(10):146-148.
[15]惠永华 ,王 路. 影响实时荧光定量 PCR技术的因素及对策.黑龙江畜牧兽医 2017.7:289-290
[16]王玮,鲁清月,李振红,等. 实时荧光定量PCR检测临床标本的前处理方法研究进展。国际检验医学杂志2018.39(3):333-335
[17] Ulrich Andergassen ,Alexandra C. Kölbl , Sven Mahner , Udo Jeschke. Real-time RT-PCR systems for CTC detection from blood samples of breast cancer and gynaecological tumour patients 。Oncol Rep. 2016 ;35(4):1905-1915. doi: 10.3892/or.2016.4608.
[18] Lee G W, Kim J Y, Koh E H, et al. Plasma human mama globin mRNA associated with poor outcome in patients with breast cancer. Genet Mol Res, 2012,11(4): 4034-4042.
[19] 陆慧琦 何金 陈佳 等.运用实时荧光定量 RT-RCR法检测乳腺癌组织中 ERPR和Her2m-RNA表达[J] 第二军医大学学报 2013;344:453-457.
[20] 弓自玉 熊兵红 马利.荧光定量RCR技术检测乳腺癌患者外周血 EGFR mRNA 及CK20mRNA 表达的意义[J] 按摩与康复医2012;32:22-23.
[21].王卉 刘水逸 吴唐维 等.MiR-21在乳腺癌中的表达及其对乳腺癌侵袭转移的影响 [J] 中华检验医学杂志2015;383:186-190.
[22] 李文仿, 张华, 王明华, 等. 检测乳腺癌组织中乳腺珠蛋白mRN的表达及临床意义[J] .胸部肿瘤, 2014, 4: 1312-1314.
[23]. Tjensvoll K, Oltedal S, Farmen R K, et al. Disseminated tumor cells in bone marrow assessed by TWISTI, cytokeratin 19, and mama globin A mRNA predict clinical outcome in operable breast cancer patients. Clinical Breast Cancer,2010,10(5): 378-384.
[24].张晓霞, 施华, 王爱军, 等. PDX-1、β-连接素在乳腺癌中的表达及预后关系的临床研究[J] 中国现代医学杂志,2014,24(4): 50-54.
[25].孙淑明, 林豪雨, 卢晓峰, 等. 外周血中PIP mRNA的表达及在乳腺癌微转移中的临床意义[J] 中国医药指南, 2014, 12(5): 5-7.
[26] Siegel R,Naishadham D,Jemal A. Cancer statistics, 2012[J]. CA Cancer J Clin,2012,62(1):10-29.
[27] Poveda-Velasco A,Casado-Hermez A,Cervantes-Ruipemz A,et al. Treatment guidelines in ovarian cancer[J]. Clin Transl 0ncol,2007,9(5):308-316.
[28] Kondalsamy C S, Hackethal A, Bowtell D, et al. Differentiating stage 1 epithelial ovarian cancer from benign ovarian tumors using a combination of tumour markers HE4, CA 125, and CEA and patient's age. Gynecol Oncol, 2013, 129(3): 467-471.
[29] Schummer M, Drecher C, Forret R, et al. Evaluation of ovarian cancer remission markers HE4, MMP7 and Mesothelin by comparison to the established marker CA125. Gynecol Oncol, 2012, 125(1):65-69.
[30].郑志芬,戴荣继。实时荧光定量PCR技术在临床肿瘤检测中的应用[J]。生命科学仪器 2014 ;12(6):20-23.
[31]. 周萍, 古力米热·乃扎尔 , 戚婷婷。袁建林RT-PCR法检测卵巢癌中CD146表达及临床意义[J]。中国继续医学教育 2018,10(3):49-51.
[32].周赞华,朱莉,董海娜 等。应用实时荧光定量 PCR检测子宫内膜癌与癌旁组织中microRNA-93 的差异表达状况[J] 。丽水学院学报 2015;37(2):48-51。
[33]程跃建.HPV DNA实时荧光定量PCR检测与宫颈癌相关性研究[J] 检验医学与临床 2018;15(24):3718-3725.