+86 13683842418
+86 13683842418
河南省洛阳市洛阳国家大学科技园
骨髓间充质干细胞的发现和来源
骨髓组织中有多种细胞成分,除基质细胞等已经分化的细胞外,还含有两类多潜能干细胞:造血干细胞和间充质干细胞。1987 年Friedenstein 等发现在塑料培养皿中培养的贴壁的骨髓单个细胞在一定条件下可分化为多种类型的细胞,而且经过20-30个培养周期仍能保持其多向分化潜能。由于骨髓中的这种多能细胞能够分化为多种中胚层来源的间质细胞, 故称之为间充质干细胞(Mesenchymalstem cells,MSCs),或间质祖细胞(MPCs),是成人多能干细胞的一类。早期分离培养时,发现其形状呈成纤维细胞样而称其为成纤维细胞集落形成单位(Colony-forming unit-fibroblast,CFU-F),或骨髓基质成纤维细胞(Marrow stromal fibroblast,MSF)。Friedenstein AJ , Chailakhyan RK,Gerasimov UV. Bone marrow o steogenic stem cells: in vit ro cult ivat ion and transp lantat ion in diffusion chambers. Cell T issue Kinet, 1987, 20 (3) : 263-267]Sciencell (Cat.No.7501 、7511、7521)
2 鉴于其强大的增殖能力及多向分化潜能,可在体外长期培养和遗传背景较稳定,而且用自体干细胞诱导构建的组织不涉及伦理问题,也不存在MHC限制,所以骨髓间充质干细胞日益受到重视。但是与造血干细胞等其他细胞相比,骨髓中MSCs的数量非常少,约占整个骨髓有核细胞的十万分之一,并随年龄的增加,细胞数量逐渐减少。因此,如何简便有效地从骨髓中获取高纯度的MSCs显得尤为重要,寻找高度特异性的MSCs的表面抗原也就成为MSCs研究中的一项重要任务和目标。不仅如此,一种同样来源于骨髓、贴壁生长、被认为更原始(可以分化为MSCs)也具有更强增殖能力的干细胞也被鉴定,它就是多能成体祖细胞(multipotent adult progenitor cell (MAPC) or mesodermal progenitorcell(MPC))[Reyes, M., Lund, T., Leuvik, T., Aguiar, D.,Koodie, L., Verfaillie,C.M. (2001) Purification and in vivo expansion of postnatal human marrowmesodermal progenitor cells. Blood 98, 2615-2625],因能和MSCs一起被纯化而统称BM stromal stem cell。
利用流式细胞仪的研究显示,MSCs属混杂细胞群,其表面抗原也具有非专一性, 它表达了间质细胞、内皮细胞和表皮细胞的表面标志。主要包括: ①黏附分子, 如CD166、CD54、CD102、CD44、CD106 等。②生长因子和细胞因子受体, 如白介素21 受体( IL-1R )、IL-3R、IL-4R、IL-6R、IL-7R、C干扰素受体( IFN-CR)、肿瘤坏死因子(TNF) -A等。③整合素家族成员, 包括CD49a、CD49b、CD49c、CD29、CD104 等。④其他如CD90、CD105 等。不表达造血细胞的表面标志, 如CD34、CD45、CD14、CD3、CD4、CD8 等, 也不表达与人白细胞抗原(HLA ) 识别有关的共刺激分子及主要组织相容性复合物类分子如HLA-DR 抗原等。
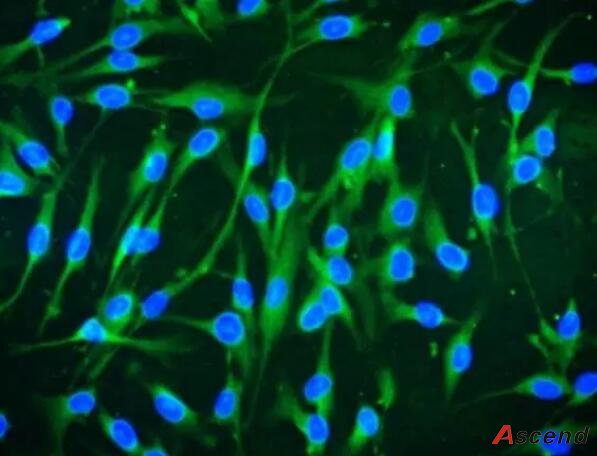
sciencell (Cat.No 7500)
骨髓间充质干细胞的分离:
目前常用的分离MSC的方法有全骨髓法和密度梯度离心法,全骨髓法即根据干细胞贴壁特性,定期换液除去不贴壁细胞,从而达到纯化MSC的目的。密度梯度离心法即根据骨髓中细胞成分比重的不同,提取单核细胞进行贴壁培养。随着对MSC表面抗原认识的深入,有人利用免疫方法如流式细胞仪法、免疫磁珠法等对其进行分离纯化,但经过流式或磁珠分选后的细胞出现了增殖缓慢等一些问题,加之耗费较大和技术的难度,在某种程度上限制了这些方法的广泛应用。
1. 直接培养法(全骨髓培养法)
1987年,Friedenstein等发现在塑料培养皿中培养的贴壁的骨髓单个核细胞在一定条件下可分化为成骨细胞、成软骨细胞、脂肪细胞和成肌细胞,而且这些细胞扩增20-30代后仍能保持其多向分化潜能,这类细胞即为骨髓间充质干细胞(BMSC),其工作对今后MSC的研究具有重要意义,不仅证实了骨髓MSC的存在,而且创建了一种体外分离和培养MSC的简便可行的方法,得到了广泛的应用。
culture-spirit采用直接贴壁法,24-36小时首次换液,换液时用PBS洗两次,7-10天传第一代,以后2-3天传代。培养基采用sciencell的间充质干细胞完全培养基(Cat.No.7501 7511 7521 )
密度梯度离心法
常规用比重为1.073g/ml的percoll分离(400g×20min)人骨髓MSCs,取界面处细胞层,离心后洗涤以2×105/cm2的密度接种,72h后更换培养液,弃掉未贴壁细胞,以后每3d换液一次。细胞长到80%汇合时1:1传代。
1. 利用PERCOLL密度1.073分离大鼠MSC 时,用2400rpm×20mins后可见中间有一层约1~2mm厚的白色层,仔细用吸管吸取这一层再用PBS离心2遍即可加培养基和胎牛血清培养即rMSCs,。
2. 利用密度为1.082的percoll分离小鼠MSCs,500g×30min离心后,取中间的单个核细胞层,PBS洗两次,接种于IMDM培养基,1d后换液,去掉非贴壁细胞,以后每3-4天换液。
MSC贴壁法培养得到的细胞不均一,但是多能分化能力和增殖力好,percoll分离得到的细胞较为均一,多能分化性和增殖力不如贴壁培养的,尤其是增殖力相差很远,有人添加bFGF或/和表皮生长因子发现可以增强增殖能力。
干细胞的诱导方法:
干细胞的体外诱导方法是在体外培养的成体干细胞中加人入诱导因子。诱导因子包括各种能影响细胞分化的物质,如血清、糖分、维生素、以及各种蛋白因子等。
2.日本学者Oh等首先报道,高浓度肝细胞生长因子(HGF)体外诱导大鼠骨髓细胞分化为肝细胞,并表达CK8, CK18, ALB等。
3.2002年,Schwartz等将大鼠、小鼠和人的多能成体前体细胞(MAPC)接种到铺有基质明胶或纤维连结素的培养瓶中,用60%DMEM(低糖型)+ 2% FCS培养体系培养,并加入HGF和/或成纤维细胞生长因子-4(FGF-4),在培养的第7天,MAPC分化为表达肝细胞核因子-3BETA,GATA-4,CK-19和AFP的上皮样细胞,在第14-28天,这些上皮样细胞表达CK-18, HNF-4和HNF-1 alfa。大约在第21天,CK-18和ALB染色阳性。这些上皮样细胞也具有肝细胞功能特征:分泌尿素和白蛋白,能摄取低密度脂蛋白并贮存糖原。
4.结果表明,用HGF和FGF-4在体外能将MAPC诱导分化成具有形态、表型和功能特征的肝细胞。实验表明,FGF-4单用可诱导肝细胞分化,用HGF处理的细胞分化程度更高。
免疫磁珠,磁珠法试剂盒,核酸提取仪:www.ex-dna.com