Source:生物磁力架Author:admin Addtime:2018/08/06 Click:
本手册用磁珠浓度超高的Sera-Mag Magnetic SpeedBeads制作比Ampure XP beads价钱低约49倍的磁珠。
药品
Tris;EDTA;蒸馏水;Sera-Mag Magnetic SpeedBeads 磁珠(Fisher 09-981-123);PEG-8000;NaCl;Tris-HCl;Tween 20;AGAROSE G-10;0.5X TAE;Thermo Scientific GeneRuler 50 bp DNA Ladder;Thermo Scientific 6X DNA Loading Dye;Solarbio GoldViewⅡ型核酸染色剂(5000x);无水乙醇;超纯水
器材
锥形瓶;量筒; 电泳仪; 分析天平;1.5ml EP管;96孔板;磁力架;移液枪及枪头;排枪;一次性塑料手套;隔热手套;微波炉;离心管架等
01
磁珠制作
1. 在50 mL灭菌后的锥形瓶中,准备TE溶液(500μL 1M Tris pH8 + 100μL 0.5M EDTA,用蒸馏水定容至50mL)。
2. 充分涡旋振荡磁珠,转移1mL到1.5mL 离心管中。
图一:Sera-Mag Magnetic SpeedBeads (Fisher 09-981-123)(半成品)
3. 将离心管置于磁力架上,直到磁珠被聚集成球,被吸附到侧壁上。
图二:磁力架(www.ex-dna.com)
4. 用移液枪移去上清液,注意:不要碰到磁珠。
5. 加1mL TE 到离心管中,从磁力架上拿下离心管 ,充分涡旋振荡,混合均匀,再放回磁力架上。
6. 重复4、5 、4步骤。
7. 加1mL TE 到离心管中,从磁力架上拿下离心管,充分涡旋振荡,混合均匀,放置到离心管架上(不是磁力架)。
8. 加入9g PEG-8000到一个新的50mL 灭菌锥形瓶中。
图三:PEG-8000
9. 加入10mL 5M NaCl (或者2.92g)到锥形瓶中。
10. 加入500μL 1M Tris-HCl 到锥形瓶中。
11. 加入100μL 0.5M EDTA 到锥形瓶中。
12. 用蒸馏水补齐锥形瓶至大约49mL。用眼睛观察,小心谨慎操作。
13. 混合3-5分钟直到溶液澄清透明,固体充分溶解。
14. 加入27.5 μL Tween 20 到锥形瓶中,轻轻混合均匀。
图四:TWEEN 20
15.将7步骤中的共1 mL的磁珠和TE溶液转移加入到14步骤中的锥形瓶中。
16.用蒸馏水定容至50 mL (如果液体未达到50mL),轻柔的混合均匀。
图五:自制磁珠(完成品)
17.避光4℃保存。
注:新制作后的磁珠必须进行试用跑胶测试。
02
磁珠分选DNA效果测试
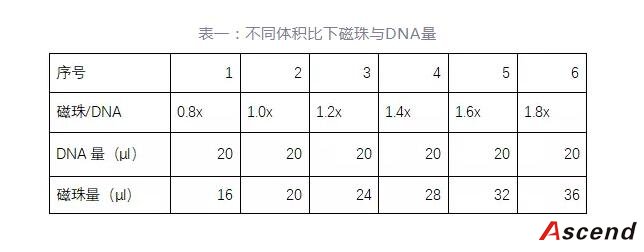
表一:不同体积比下磁珠与DNA量
1. 准备试剂:
用2个50ml离心管分别盛装超纯水和80%乙醇(配置80%乙醇:40ml无水乙醇+10ml超纯水。现用现配)
3个1.5ml EP管,分别标记“1” “2” “DNA”
2. 1号EP管-不加磁珠的空白对照:1μl Ladder+9μl超纯水
2号EP管-跑胶用Loading Dye:1μl Loading Dye +9 μl超纯水(因制胶时使用 Solarbio GoldViewⅡ型核酸染色剂(5000x)的要求,Loading Dye需再稀释10倍)
DNA管: 9.6μl Ladder+150.4μl超纯水(实际准备8份DNA量,每份1.2μl Ladder+18.8μl超纯水,防止药品不足或实验失误。)
图六:Thermo Scientific GeneRuler 50 bp DNA Ladder
图七: Thermo Scientific 6X DNA Loading Dye
3.从4度冷藏箱中取出避光保存的磁珠,涡旋混匀。
取一个96孔板,按照上表用量加入DNA和磁珠,加好后用移液枪反复吸吐混匀。
混匀后静置2min,然后将96孔板放置到磁力架上。
图八:上:96孔板
下:磁力架(实验室自制)
注意:移动96孔板的过程中手套不要接触孔口,避免污染DNA.
4. 放上磁力架等待一段时间,可以看到溶液呈透明。此时用移液枪将上清液吸出弃去。
注意:吸出上清液时,移液枪不要碰到磁珠。建议枪头轻微偏向磁珠的反方向。
5. 用排枪吸取80%乙醇200μl,加入六个孔中,静置1min(计时器计时)。
1min后用排枪吸出乙醇弃去
再用排枪吸取80%乙醇200μl,加入六个孔中。加入后,即可用移液枪将乙醇吸出(不需要静置),并且要求吸干乙醇,尽量没有残留。
将孔板拿下磁力架,静置直至孔内壁没有水珠。
注意:最后一步静置晾干时不能太干,时间控制在3~10min,如果孔壁内有较大液珠,可以用移液枪吸出,同时要求不能接触磁珠
6. 晾干后,用移液枪向每孔中各自加入20μl超纯水,并反复吸吐10次以上,保证混匀。
7. 将96孔板放上磁力架,可以看到溶液在短时间内变澄清。
8. 用移液枪吸出上清液,分别移至对应编号的新孔中。此时得到的是磁珠上吸附的也是我们所需的DNA
注意:吸出上清液时一定不要吸出磁珠。为了避免这种情况,可以适当调小移液枪如调至19μl
03
点样
1. 使用前将1号EP管(未加磁珠的Ladder对照)和2号EP管(稀释好的Loading Dye)中的液体反复吸吐混匀
2. 因为点样的量很少,所以在干净的一次性塑料手套上混合好样品。
孔1~6: 5μl DNA (磁珠过滤后)+1μl 2号EP管(稀释好的Loading Dye)
孔7: 3μl 1号EP管(未加磁珠的Ladder对照)+1μl 2号EP管(稀释好的Loading Dye)+2μl超纯水
注意:点样时移液枪中不要有气泡,避免气泡将孔内DNA带出,跑胶没有结果
枪头不要戳破胶
04
跑胶
电泳仪参数设置为180V 30min
在这个实验中作为对比的DNA Ladder与用于检验磁珠吸附能力的DNA均是原Ladder稀释20倍所得;Loading Dye是原药剂稀释60倍所得。
05
结果
图九:跑胶结果图(不同体积比的磁珠与DNA对应筛选出的DNA片段大小)
相关文献
1. 磁珠官方介绍手册:https://www.ex-dna.com
2. 原始实验手册为印第安纳大学伯明顿分校生物系 Kimberly Young所提供
生物磁力架,氨基羧基硅基羟基链霉亲和素磁珠:www.ex-dna.com