+86 13683842418
+86 13683842418
河南省洛阳市洛阳国家大学科技园
荧光定量PCR的主要概念
什 么 是 荧 光 定 量 PCR ?
常规 PCR 中,扩增产物(扩增子)是通过终点法来分析检测,即 PCR 反应结束后,DNA 通过琼脂糖凝胶电泳,然后进行成像分析。而荧光定量 PCR 可以在反应进行过程中进行累积扩增产物的分析和检测,即“实时”。
在反应体系中加入荧光分子,通过荧光信号的按比例增加来反应 DNA 量的增加,使 PCR 产物的实时检测成为可能。满足实验目的的荧光化学物质包括 DNA 结合染料和荧光标记的序列特异引物或探针;专门的热循环仪配备荧光检测模块,用于监测扩增时的荧光,检测到的荧光信号反映了每个循环扩增产物的量。
相对常规 PCR 而言,荧光定量 PCR 的主要优点是准确地确定初始模板拷贝数和宽的动态范围内和高的灵敏度。荧光定量 PCR 结果可以用于定性(判断一段序列的有无),也可以用于定量(确定 DNA 拷贝数),即 qPCR,而常规 PCR 只能做半定量。另外,荧光定量 PCR 的结果无需通过琼脂糖凝胶电泳来评估,大大节省实验时间,提高实验效率。还有,由于 PCR 反应和检测都在反应管中进行,样品污染的几率大大降低,无需扩增后的实验操作。
荧光定量PCR工作原理
为了更好的了解荧光定量 PCR 原理,用样品扩增曲线来说明 ( 图 1.1)。图中, x-轴表示 PCR 循环数,y-轴表示扩增反应的荧光值,与反应管中扩增产物的量有比例关系。
扩增曲线显示 2 个阶段,指数增长阶段和之后出现的非指数平台阶段。在指数增长阶段,每个循环 PCR 产物量大约增加一倍。然而,随着反应的进行,反应体系组成成分的消耗,其中的一种或多种成分限制反应。此时,产物增长速度变慢,反应进入平台期(图 1.1 中 28-40 个循环)。
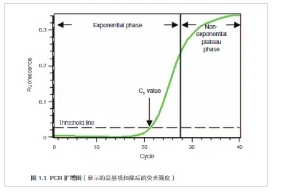
反应最初,虽然产物是指数增长,但是荧光处于背景水平,检测不到荧光增加(图 1.1 中 1-18 个循环)。 当累积了足够的扩增产物,可以产生可检测的荧光信号时,这个循环数叫初始循环数,即 CT。由于 CT 值处于指数期内,这时的反应成分不会抑制扩增反应进行,因此荧光定量 PCR 结果是可靠的,可以准确地反映反应体系中模板的初始量。
CT 值主要由扩增反应体系中模板的初始浓度决定的。如果模板初始浓度高,只需要较少的扩增循环就可以累积足够的产物,产生高过背景的荧光信号,因此,反应就有一个小或早出现的 CT ;相反,如果模板初始浓度低,需要较多的扩增循环才能产生高过背景的荧光信号,反应就有一个大或迟出现的 CT。两者之间关系的建立是荧光定量 PCR 用于定量的依据。
由于实时定量建立在模板的初始浓度与CT关系的基础上,因此荧光定量PCR的优化非常重要,保证样本具有准确可重复的实验结果。优化的 qPCR 结果有以下特点:
1.线性的标准曲线(R2 > 0.980 或 r > |–0.990|)
2.高扩增效率(90-105%)
3.一致的重复反应
一种有效的用来确定qPCR实验是否是最优化的方法:将模板稀释成一系列浓度梯度进行 PCR 反应,用这个结果作标准曲线,模板可以用已知浓度的样品(如纳克级的基因组 DNA 或多个拷贝的质粒 DNA)或未知浓度的样品(如 cDNA)。用模板初始量(或未知量样品的稀释倍数)的 log 值对每个稀释样品的 CT 值作图,两者呈递减的线性关系,称之为标准曲线。递减的直线关系等式和 Pearson 相关性系数(r)或可信度(R2)常常被用来判断 qPCR 条件是否优化。
理论上,一系列稀释样品的扩增曲线之间有均匀的间距,如图 1.2A 所示。如果产物在每一循环都加倍,荧光曲线之间的间距由等式“2n = 稀释倍数”决定,这里 n是阈值线上扩增曲线之间的循环数(或称为 CT 的差异)。例如,10 倍稀释的 DNA 样品,2n = 10,因此,n = 3.32,CT 值相差 3.32 个循环,由均匀间距的扩增曲线可以产生一个线性的标准曲线,如图 1.2B 所示,图中显示等式和递减线性的 r 值。
标准曲线的 r 或 R2 值显示实验数据满足衰减的线性程度,即数据的线性程度。线性用来衡量重复样品数据是否一致和不同拷贝数的初始模板是否具有相同的扩增效率。如果重复样品的 CT 值明显不同,r 或 R2 值会变低,你应该优化反应条件,保证 qPCR反应的 r 的绝对值 >0.990 或 R2 值 >0.980。
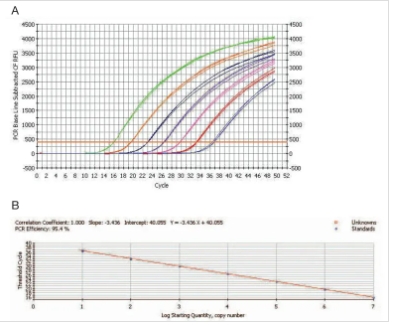
图 1.2. 作标准曲线来评定反应条件的优化。用实时定量 PCR 仪扩增 10 倍稀释模板的样品实验数据作标准曲线, 每个稀释样品重复三次。A. 系列稀释模板的样品扩增曲线。B. 每个稀释样品的CT值对初始模板量的log 值作的标准曲线。图中显示递减直线的等式和 r 值,计算的扩增效率为95.4%。
扩增效率,E,与标准曲线的斜率相关,计算方程等式如下:
E = 10–1/斜率
理论上,在每个指数扩增循环中,PCR 产物的量加倍,即 PCR 产物 2 倍增加,
反应效率为 2。在上面等式中反应效率等于 2,2 = 10–1/斜率,那么,优化的标准曲线斜率应为 –3.32,斜率的绝对值与上面的荧光曲线间距相同。
扩增效率用百分率表示,即每个循环扩增模板的百分比,将扩增效率 E 转换成百分率为:
% 效率 = (E – 1) x 100%
对于一个理想的反应,% 效率 = (2 – 1) x 100%= 100% 。
图 1.2 中显示的反应:
E = 10–(1/–3.436) = 1.954
% 效率 = (1.954 – 1) x 100% = 95.4%
每个循环的终点,扩增子的拷贝数增加 1.95 倍,或 95.4% 的模板被扩增。
扩增效率接近 100% 是优化的重复性好的实验的最好标志。实际操作时,反应的扩增效率应该在 90–105% 之间,如果扩增效率低,可能的原因是引物设计的不当,或者反应条件未优化;扩增效率 >100%,可能的原因是系列稀释样品加样错误,或者有非特异性产物扩增,如引物二聚体产生。用上述方法确定扩增效率,反应体系中反应抑制剂的出现也可能导致扩增效率的明显增加,原因是含有高浓度模板的样本通常也含有高浓度的抑制剂,导致反应的 CT 延迟出现,而低浓度模板的样本中抑制剂的浓度低,反应的 CT 延迟的程度最小,导致斜率的绝对值以及计算所得的扩增效率会增加。如果扩增效率 <90% 或 >105%,建议重新设计引物或探针。