Source:生物磁力架Author:admin Addtime:2018/08/22 Click:
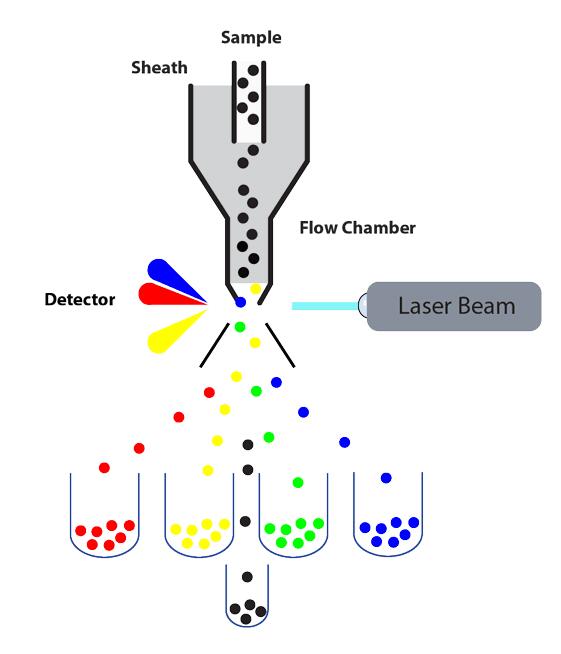
磁珠和流式都可以分选细胞,那么什么时候应该用流式分选呢?流式分选有哪些优劣呢?在下面这幅流式多路分选的动画下面,流式中文网站友们展开了激烈讨论。
简单说一下原理:
现在流式分选一般都是电荷式分选,即对感兴趣的目标细胞所在的液滴充上电荷,液滴经过电极板,通过电场作用发生偏转,从而实现分选。
磁珠分选首先使用磁珠偶联的抗体去标记细胞,然后把标记好的细胞过柱子(柱子周围连磁铁),带磁珠的细胞就留在柱子上,不带磁珠的细胞就流走了,从而实现分选。
现在可以比较不同了:
1、对细胞的刺激。 我觉得磁珠分选最大的优势就是对细胞的刺激要小一点。因为流式分选细胞首先要经过几十微米的喷嘴,然后要被充电,还要经过几千伏的电场,最后以几十米每秒的速度落到收集管里面,有些原代细胞就受不了,分选免疫细胞也要考虑细胞活化的影响;而磁珠分选相对来说就对细胞没什么刺激。
2、设备要求。 磁珠分选小的实验室就能做,买一些专用的磁铁和柱子就可以了,而流式分选就需要分选型的流式细胞仪,都是几百万以上的。对操作员的要求来说,流式分选也要高一点,需要专门培训,需要注意的细节也要多很多。
当然如果你周围有什么流式平台的话,磁珠分选和流式分选的成本应该是差不多的,流式分选一次大约1-2千(各地方不同),磁珠分选的柱子磁珠差不多也要烧这么多钱。
3、试剂不同。 这个最好理解,流式分选用的是荧光素偶联的抗体,磁珠分选用的是磁珠结合的抗体。
下面就要说下流式分选的优势了:
4、分选纯度。这个肯定是流式分选的纯度高,磁珠分选如果操作好的话也能达到80-90%的纯度,但流式分选一般都能达到90%以上(样本制备和仪器条件正常的条件下)。
5、多参数分选。流式细胞术很大的优势就是多参数,比如我可以分选CD4+CD25+CD127low的Treg,三色的一次就能分选。磁珠分选就必须先分CD4,再分CD25,更多参数的就没法进行。
6、低表达群细胞分选。比如有些干细胞它的表达比例只有百分之零点几,比例太少磁珠分选无法操作,流式就可以把这些细胞富集起来。
7、胞内荧光分选。流式分选在分子生物学中很大一部分应用就是分选GFP、YFP等阳性细胞,还有可以用Hoechst染精子的单倍体进行分选,这些针对胞内成分的分选也是磁珠分选无法实现的。
另外要说明的是,现在都很流行磁珠分选和流式分选相结合的方法,像上面举的例子分选CD4+CD25+CD127low的Treg,如果仅用流式分选可能时间太长,纯度也有影响。那么可以选择先用磁珠纯化出CD4阳性的细胞,再过流式分选CD4+CD25+CD127low的群体,这样既节省了时间保证了活性,也可以提高分选的纯度。
以上就是我能想到的了,欢迎大家补充。
我不了解流式分选,但是美天旖的磁珠我倒是用了2年了,分选的Naive T纯度95%以上,80-90%有点少,是不符合实验要求的。我觉得他更大的好处是,比较能保证无菌,适合后期细胞的再培养,而且分选量比较大。
楼上的说的很对啊,我再补充详细点。
首先要说明的是,流式分选直接分选的是液滴,本来鞘液包裹着细胞流是连续的液流,经过高频率的振荡器被断裂成一个一个独立的小液滴,理想的情况下,每个液滴里面就包裹着一个细胞(当然还存在一个液滴里面有几个细胞的情况,这就涉及到分选模式的问题了,不详述),如果这个液滴里面的细胞是目标细胞,机器就会在液滴离开液流的一瞬间给它充个电荷。
至于机器是怎么给它充电荷,充多少电量的电荷,我们不需要管,只需要设置好就可以了,比如我们BDAriaII有一个sort layout窗口,如果你想分选FITC、PE、APC和PerCP-Cy5.5四个population(四路分选),你就在窗口里设置好(如图),机器就会自动给相对应的液滴充上电性和电量不同的电荷,使其偏转到左一、左二、右一、右二接收管里。
其实这个纯度我只是一个保守的说法,淋巴细胞分选是最成熟的,我检测过CD4和CD8的磁珠分选确实能超过90%,对于这种常见的单参数分选,流式分选能达到99%以上。
污染的情况流式分选确实存在这个风险,如果操作得当,收集管里加好抗生素和抗真菌素,一般不会污染的。
现在流式分选速度也已经很快了,普通分选仪进样速度最起码也有10000个/s,如果有50%的阳性率,每秒能分选5000个,一小时也能分选到1.8X10e7,相当可观了。
上面的讨论是3年前的了,尽管时间较久,但内容十分精彩。今天,Arcrain站友为我们仔细列出来几种其它细胞分离方法不能替代的情况:
(1)要求目标细胞群有极高的纯度(95%-100%);
(2)需要分离低密度表面受体/抗原的细胞;(弱阳性细胞)
(3)需要根据表面受体密度的差别来分离不同细胞;(根据免疫表型的分选,抗体亲和力进化等)
(4)需要依据多色荧光标记来分选细胞;
(5)根据某些细胞内部标志,如DNA含量、胞内抗原等分离细胞。
(6)多孔板分选。如单克隆分选,在96孔板每个孔中精确的分选进1个细胞。
(7)需要分选极低含量的细胞(如0.001%或更低)。流式可以分选出百万分之一的稀有细胞
免疫磁珠:www.ex-dna.com