+86 13683842418
+86 13683842418
河南省洛阳市洛阳国家大学科技园
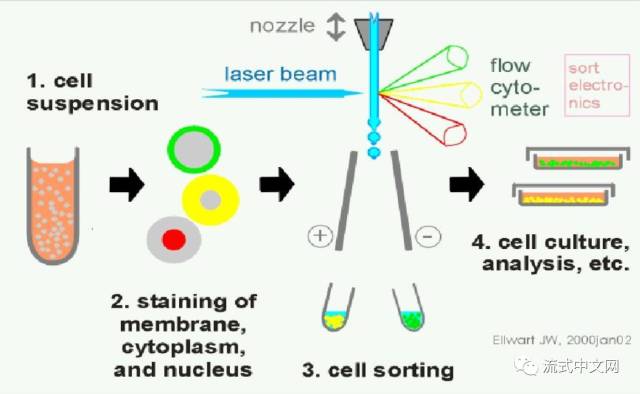
Q1:何时应该在大量分离方法(如平移或磁珠分离)上使用流式分选?
A:
a)当需要非常高的纯度(95%-100%)的目标群体时。
b)用于分离其表面上具有低密度受体的群体。
c)根据表面受体密度浓缩表达量不同的群体。
d)基于多色染色分选细胞。
e)基于内部染色(例如DNA或胞内抗原)分选细胞。
Q2:我的细胞会被分选所伤害吗?
A:一般来说,细胞不会受到分选过程本身的伤害,只要它们保持在最适合它们的温度、pH值以及培养基中。
Q3:我需要准备好多少个细胞来分选出1×10E6个目标细胞,原细胞群包含10%目标细胞。
A:1 X 10E6 = 10%目标群体×50%回收率×20×10E6起始细胞数。 50%的回收率是一个合理的数字,但是用回收细胞的实际效率取决于许多因素:
a)由于细胞粘附管壁造成的分选前和分选后的丢失。
b)分选速率。分选速率越高,回收率越低。
c)流式细胞仪的分类精度。
d)如果是浓缩分选或纯度分选。浓缩分选比纯度分选有更高的回收率。
Q4:有办法提高分选回收率吗?
A:有。
a)使用聚丙烯管进行进行细胞处理和分选。
b)在分选之前(全部洗涤完毕后)计数细胞。
c)使用空白Hank's液做鞘液,不要用PBS。
d)使用聚丙烯收集管,并用含有20%血清的培养基填充1/3以上体积。
e)摸索最佳温度(4°C或15°C或室温)。
f)分选时每一个小时倒转一次管子。
g)分选时收集管如果满了或者分选结束时,立即处理收集管。
h)离心收集管的时间限定在〜10分钟
Q5:单克隆抗体标记细胞时,是否必须按照常规染色时细胞数:抗体量的比例进行计算抗体用量?
A:我们的经验表明,在体积为0.5 ml的缓冲液中孵育2~3千万个细胞,先按照常规染色的细胞数:抗体比例计算出理论用量,只需要用理论用量的1/4~1/5即可。
Q6:平均分选需要多长时间?
A:平均分选需要大约1小时设置仪器、约15分钟设置分选区域、约30分钟进行分选后分析。 分选20×10E6个细胞的分选需要2到4个小时, 然而实际时间与样品中目标细胞的百分比、研究者要求的纯度、细胞数等密切相关。进行无菌分选时,流式细胞仪的设置时间约为90分钟。
Q7:是否可以同时分选阳性细胞和阴性细胞?
A:是的,两类细胞可以分别收集到左边和右边的分选管中。 还可以将靶细胞收集到一个管中,将剩余的所有细胞连同废液收集到另一个收集管中。
Q8:实际上可以有多少比例的细胞可被回收,回收率取决于什么?
A:一般来说,预计理论细胞数量的50%可以被回收。 回收率的高低是由Q3答案中已经讨论的因素造成的。
Q9:如何在分选过程中确保细胞活力,有什么改进方法吗?
A:样品应保存在最适合它们的富营养培养基中。一般建议血清浓度尽量高一些,因为在分选过程中,血清浓度会被收集到管中的鞘液稀释。收集管尽量保持在最佳温度,并含有用于保存细胞活力的培养基。在分选完成后尽快处理分选后的细胞有助于保持细胞活力。
Q10:分选中细胞重悬最佳培养基和最佳浓度是否能推荐?
A:我们一般用含有25 mmol Hepes和2%~10%血清的RPMI 1640重悬细胞,细胞密度约6~8×10E6/ml,这样可以在低压力下分选样本,提高细胞群分辨率。不过,对于倾向于过度聚集的细胞,可以用更低密度,例如4~5×10E6/ml重悬细胞。
Q11:每秒可以在FACStar流式细胞仪上分选多少个细胞?
A:仪器上的最大事件发生率是每秒10000个事件。对于高纯度,每秒2500次的事件是典型和可取的。
Q12:可以分选出细胞的最大纯度是多少,它取决于什么
A:最高纯度为99%至100%。对于分群良好的细胞群体,可以预期95%至100%的纯度。纯度主要依赖于流式细胞仪的稳定性和分选门的设置方式。这些门应始终与研究者一起设置,以帮助作出决定。
Q13:是否可以进行无菌分类,并将分选后的细胞进行培养?
A:是的。如果有可能,尽量从分选后的细胞中分出多瓶进行培养,即使其中一瓶培养时污染,其它瓶子也可以继续培养。
Q14:是否有可能分选出<1%的细胞群,是否需要在分选前进行富集?
A:可以的。可以进行稀有事件分选,但是通过纯度较低、得率较低。因此,如果有可能,尽量通过各种方法或浓缩分选来富集。
Q15:可以通过加入碘化丙啶来排除分选细胞中的死细胞,对分选细胞是否有毒性?
A:活细胞可以通过加入低浓度碘化丙啶(PI)排除死细胞获得。我们实验室尚未确定PI对活细胞的毒性作用,但效果应该是小的,因为PI仅被动地附着在活细胞上,应该通过洗涤来移除。另一种死活鉴别染料7-AAD也是同样道理。
Q16:FACStar流式细胞仪可以同时使用多少参数进行分选?
A:目前可用的参数数为6:四个荧光参数、前向散射和侧向散射。荧光面积和宽度、参数之间的比例可能会在未来作为分选参数使用。
Q17:分选细胞群的纯度如何确定?
A:通过流式细胞仪再获取一点细胞,分析分选后细胞的比例。